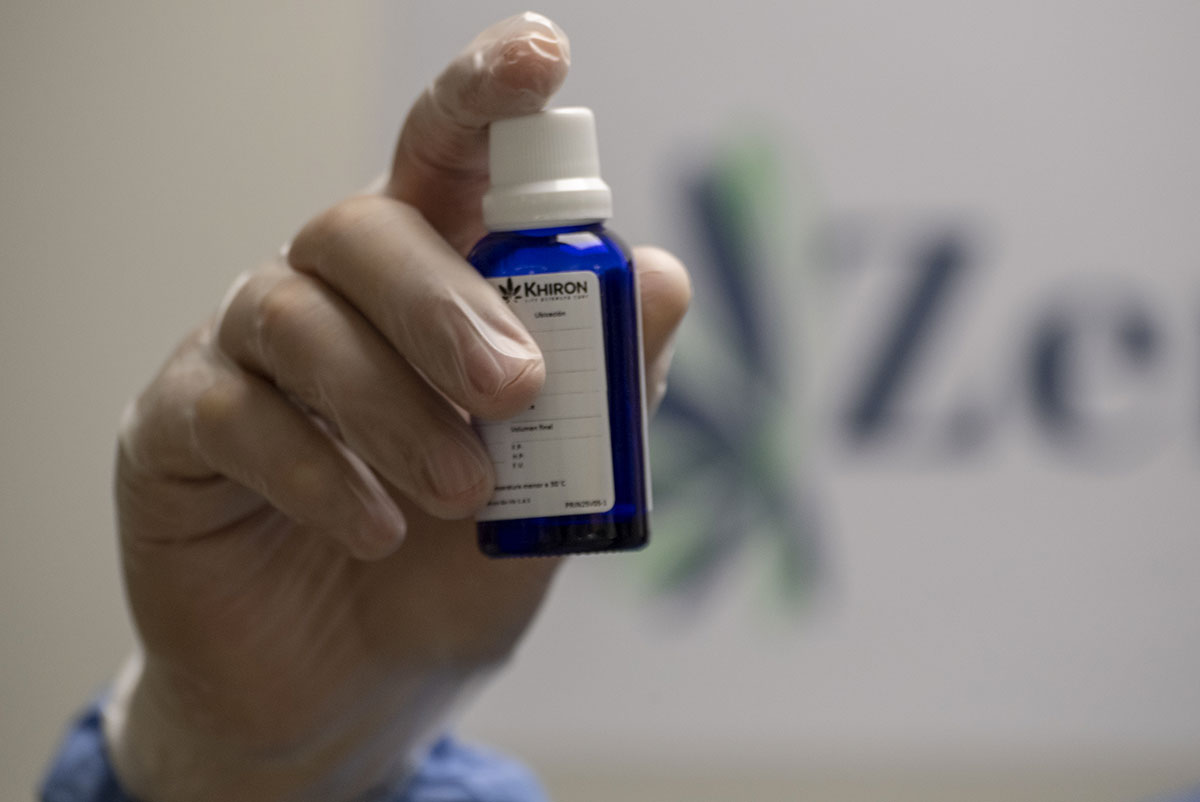
Paris, France | AFP | dimanche 18/10/2020 - Le cahier des charges des futurs médicaments à base de cannabis, qui seront utilisés dans le cadre d'une expérimentation à partir de l'année prochaine, a été publié dimanche.
Il s'agit de la dernière étape avant le choix des fournisseurs.
L'expérimentation du cannabis thérapeutique, votée par l'Assemblée nationale il y a un an, a été autorisée par un décret paru le 9 octobre.
Elle doit commencer "au plus tard à compter du 31 mars", "pour une durée de deux ans", et concernera au moins 3.000 patients.
L'arrêté publié dimanche au Journal officiel vient confirmer quelles formes pharmaceutiques seront autorisées et dans quels cas elles pourront être utilisées.
Les médicaments se présenteront sous forme d'huiles, de gélules et de fleurs séchées à vaporiser. Ils ne seront administrés qu'à des patients souffrant de maladies graves (certaines formes d'épilepsies, de douleurs neuropathiques, d'effets secondaires de chimiothérapie, de soins palliatifs ou de scléroses en plaques) et seulement "en cas de soulagement insuffisant ou d'une mauvaise tolérance" avec les traitements déjà existants.
Pour chaque forme de médicament, un fournisseur principal et un fournisseur secondaire "en cas de défaillance du premier" seront sélectionnés, indique le cahier des charges en annexe de l'arrêté.
Le texte détaille aussi les caractéristiques des produits, et notamment les dosages précis autorisés pour les deux substances actives du cannabis (le THC et le CBD), les contrôles de qualité qui seront réalisés et les obligations incombant aux fournisseurs. Ceux-ci seront notamment responsables de la traçabilité des produits et de la "sécurisation du circuit de leur distribution".
L'Agence nationale de sécurité du médicament (ANSM) doit désormais publier sur son site l'appel à candidatures pour sélectionner les prestataires qui fourniront les médicaments.
Cette expérimentation, très attendue par les associations de patients, devait initialement être lancée en septembre 2020, mais l'ANSM avait annoncé cet été un report à janvier 2021 en raison des imprévus liés à l'épidémie de Covid-19.
Le cannabis à usage médical est autorisé dans une trentaine de pays. En Europe, les Pays-Bas en ont été les pionniers dès 2003. Ils ont été suivis depuis par 22 pays (sur 27), dont la France désormais.
Il s'agit de la dernière étape avant le choix des fournisseurs.
L'expérimentation du cannabis thérapeutique, votée par l'Assemblée nationale il y a un an, a été autorisée par un décret paru le 9 octobre.
Elle doit commencer "au plus tard à compter du 31 mars", "pour une durée de deux ans", et concernera au moins 3.000 patients.
L'arrêté publié dimanche au Journal officiel vient confirmer quelles formes pharmaceutiques seront autorisées et dans quels cas elles pourront être utilisées.
Les médicaments se présenteront sous forme d'huiles, de gélules et de fleurs séchées à vaporiser. Ils ne seront administrés qu'à des patients souffrant de maladies graves (certaines formes d'épilepsies, de douleurs neuropathiques, d'effets secondaires de chimiothérapie, de soins palliatifs ou de scléroses en plaques) et seulement "en cas de soulagement insuffisant ou d'une mauvaise tolérance" avec les traitements déjà existants.
Pour chaque forme de médicament, un fournisseur principal et un fournisseur secondaire "en cas de défaillance du premier" seront sélectionnés, indique le cahier des charges en annexe de l'arrêté.
Le texte détaille aussi les caractéristiques des produits, et notamment les dosages précis autorisés pour les deux substances actives du cannabis (le THC et le CBD), les contrôles de qualité qui seront réalisés et les obligations incombant aux fournisseurs. Ceux-ci seront notamment responsables de la traçabilité des produits et de la "sécurisation du circuit de leur distribution".
L'Agence nationale de sécurité du médicament (ANSM) doit désormais publier sur son site l'appel à candidatures pour sélectionner les prestataires qui fourniront les médicaments.
Cette expérimentation, très attendue par les associations de patients, devait initialement être lancée en septembre 2020, mais l'ANSM avait annoncé cet été un report à janvier 2021 en raison des imprévus liés à l'épidémie de Covid-19.
Le cannabis à usage médical est autorisé dans une trentaine de pays. En Europe, les Pays-Bas en ont été les pionniers dès 2003. Ils ont été suivis depuis par 22 pays (sur 27), dont la France désormais.